Uus maailm – elamine ja elude päästmine
Alates 26. maist 2020 pidi Euroopa Liidus kohalduma meditsiiniseadmete määrus (MDR). COVID-19 tõttu lükati see ühe aasta võrra edasi.
Kuid pärast aastatepikkust arutelu saab uuest raamistikust varsti reaalsus. Ja tootjad, valitsusasutused, reguleerivad asutused ning tarbijad peavad seda kohaldama. Mis on meie arvamus? Kas MDR suurendab patsientide ohutust? Või nõrgendatakse sellega tööstuse innovatsioonijõudu? Ja mida me nüüd teeme? Eksklusiivne B. Brauni uuring tervishoiusüsteemi kõigil tasanditel: üks reform. Seitse jaama. Seitse võimalust.
1. jaam: idee
Andreas Schwab on Euroopa Parlamendi liige 2004. aastast. Ja CDU poliitik on peaaegu kogu selle aja MDR-iga tegelenud. „Poliitikuid survestati tohutult,“ ütleb Schwab „ja meediakajastus oli üsna eelarvamuslik. See on meie töö keeruliseks muutnud.“ 2017. aasta mais võeti MDR vastu. Esimeste seadmeklasside kolmeaastane üleminekuperiood on lõppemas. Kuid Andreas Schwab teab, et see teema pakub talle veel väga pikalt tegevust.
„2010. aastal põhjustasid Poly Implant Prothèse'i defektsed rinnaimplantaadid Prantsusmaal palju kära. Selle ettevõtte äritegevus ei vastanud isegi tolle aja kohta eeskirjadele. Samas tegi see niinimetatud PiP skandaal selgeks, et meil puudusid tõhusad kontrollid. MDR kehtestab esimest korda Euroopas ühtse määruste kohaldamise. Tehakse ka etteteatamata kontrollkäike. See suurendab patsientide turvalisust. Võtsin MDR-i arvamusavalduse Prantsuse kolleegilt Euroopa Parlamendi siseturu- ja tarbijakaitsekomisjonis, rääkisin paljude oma valimisringkonna ettevõtete ja teadlastega ning kutsusin komisjoni Edela-Saksamaale. Ma mõistan väga hästi, et mõned tootjad kaebavad, sest peavad tõestama olemasolevate seadmete tõhusust ja ohutust. Kuigi probleeme on olnud vaid mõne musta lambaga, peame tagama, et kõik tooted vastaksid kõige kaasaegsematele standarditele, tagamaks parima võimaliku patsiendiohutuse. Mõnda aega tagasi väljendasin oma muret, et Euroopa Parlament oli rakendamistähtaegade suhtes liiga ambitsioonikas, kuid see mure on lahenenud. Vajame MDR-i rakendamiseks organiseerituse ja kiiruse kombinatsiooni.“
2. jaam: strateegia
Euroopa Komisjon lükkas 2019. aasta lõpus edasi tähtaja, milleks tuleb uue määruse kohaselt sertifitseerida niinimetatud 1R-klassi seadmed, näiteks korduvkasutatavad kirurgilised instrumendid. Kuid kas sellest on tootjatele abi? B. Brauni Aesculapi osakond on Tuttlingenis meditsiiniseadmeid tootnud 1867. aastast. B. Brauni juhatuse liige dr Joachim Schulz selgitab, miks tagasiteed ei ole.
„MDR-il on patsientidele selged eelised: näiteks on minu arvates tõsi, et tootjad ei saa enam tugineda ainult III klassi seadmete (nt implantaatide) heakskiitmise samaväärsuse põhimõttele, nad peavad tegema uusi kliinilisi uuringuid. Kui me peame aga tõestama, et kirurgilisi kääre, millest mõnda oleme tootnud ja tarninud juba üle 100 aasta, saab steriliseerida aursteriliseerimisega, kulutame me selleks tarbetut ressurssi ja meie uuenduslik tugevus väheneb. MDR on loonud uue maailma. 50–60 protsenti meie töötajatest arendus- ja õigusosakondades tegelevad praegu olemasolevate seadmete dokumentatsiooni säilitamisega. Suure ettevõttena on B. Braunil vähemalt võimalus mitmeid katseid läbi viia, mida nüüd ettevõttesiseselt nõutakse. Ja me ei plaani loorberitele puhkama jääda, oleme juba oma pilgud tulevikku suunanud. Tehnoloogiad muutuvad kiiresti: sellised arengud nagu põletikke ennetavad efektiivsed pinnad või operatsioonisaali robotiseerimine, on tohutult potentsiaalikad. Tõtt-öelda leiutaksime parem teedrajavaid seadmeid kui uuriksime vanu faile.“
3. jaam: katsestendil
Lisaks sellele, et MDR muudab meditsiiniseadmete tootjate tegevust, kaotavad kõik teavitatud asutused oma tähistuse vana ELi MD-direktiivi alusel. Kui 2012. aastal oli kogu Euroopas veel 83 teavitatud asutust, siis praegu on neid vaid kümme. Ja seda numbrit pole võimalik järsult tõsta, kuna taotlusprotsess kestab poolteist aastat, nagu selgitab dr Bassil Akra, Müncheni TÜV SÜD-i globaalse strateegilise äriarenduse asepresident.
„Oleme 2015. aastast alates TÜV SÜD-is oma võimsust igal aastal 20% võrra suurendanud. Vaatamata sellele ei ole meil siiski võimalik kohe kõiki tootjate MDR-sertifikaatide taotlusi töödelda. Sellegipoolest ei näe ma praegu meditsiiniseadmete kättesaadavuse osas mingit hädaolukorda, kuna enamik tootjaid on seni keskendunud seadmete sertifikaatide pikendamisele 2024. aastani. Nii et tegelik MDR-i töö ootab meid veel ees. Põhimõtteliselt arvan, et suurem järelevalve ja õigusliku olukorra ühtlustamine, mida MDR sätestab, on väga loogiline. Kuid 175-leheküljelises regulatsioonis on palju mitmemõttelisust ning erinevaid tõlgendamisvõimalusi. Näiteks öeldakse seal, et teavitatud asutused peavad tagama „piisavad seiresüsteemid“. Kuid mida "piisav“ tegelikult tähendab? Siiani on avaldatud 32 juhisdokumenti, millega Euroopa Komisjon plaanib oma seisukohta selgitada. 2020. aasta maiks järgneb neile veel 30. Me peame loomulikult ütlema ka, et Euroopas ei saavutata kunagi 100% ühtlustamist. Liikmesriikide keeled, kultuurid ja õigustavad on selleks lihtsalt liiga erinevad. Kui määruse järgi peavad teavitatud asutuste uurijad olema „kliinilise pädevusega“, mõistame Saksamaal, et see tähendab erialase kvalifikatsiooniga arsti. Mõnes teises riigis piisab, kui uurijatel on bakalaureusekraad õenduses või, lihtsamalt öeldes, kui nad on haiglas töötanud. Teile ei pruugi see meeldida. Kuid see on osa tänapäeva ühendatud Euroopa mitmekesisusest.“
4. jaam: siseprotsessid
B. Braunil on ainuüksi haiglaravi osakondi 40 asukohas. Meditsiiniseadmeid toodetakse neist 18-s. Jürgen Heil, kvaliteedi- ja keskkonnajuhtimise asepresident selgitab, kuidas MDR keerukaid tootmisprotsesse muudab.
„Kujundasime tühjal paberilehel täielikult ümber kliiniku, arenduse, tootmise ja elutsükli juhtimise kvaliteediprotsessid ning tehnilise dokumentatsiooni. See on hiigelsuur ettevõtmine, mis on üksnes meie haiglaravi osakonnas pakkunud mitme aasta jooksul tööd enam kui 100 eksperdile: kvaliteedijuhtimine, regulatiivküsimused, arendamine, tootmine, meditsiiniteadus, õigus, IT, turundus ja müük. MDR esitab nii palju uusi nõudmisi, et pidime üle vaatama kõik oma välised ja sisemised protsessid ning neid vajaduse korral ümber korraldama. Mõne ülesandega saime väga kiiresti hakkama: näiteks kvaliteedijuhtimise sertifitseerimine uusima standardi järgi (ISO 13458:2016) 2018. aasta lõpus. Üks ülesanne, mis meid endiselt tegevuses hoiab, on see, et igale tootele tuleb lisaks meditsiiniseadme etiketile lisada ka kordumatu seadme identifitseerimiskood, mis kuvatakse Euroopa andmebaasis (EUDAMED). Kuid see andmebaas ei saa lähitulevikus juurdepääsetavaks. Oleme pidanud enam kui 140 tooteperele (nagu veenisisese manustamise komplektid või intravenoossed kateetrid) looma tehnilise dokumentatsiooni ja kinnitustõendid ning need standardiseeritud protseduuri kohaselt andmebaasis kättesaadavaks teinud. See tähendab kuni 140 dokumenti seadme kohta. Kuid kuna oleme selle teemaga pingsalt 2016. aasta lõpust töötanud, planeerisime näiteks teavitatud asutusse ressursse aasta tagasi, lõpetasime edukalt MDR-i auditi eelmise aasta septembris. Me oleme soodsal positsioonil ja saame rahustada oma kliente, kes küsivad saadavuse ja sertifitseerimise kohta. Kuid pidime siiski mõned seadmed ja komplektid portfooliost välja jätma. Näiteks välistootjate toodete puhul peame uue määruse alusel tõestama, et meil on juurdepääs nende tehnilisele dokumentatsioonile, mis ei ole sageli üldse lubatud.“
5. jaam: turg
Prospitalia ostuühing esindab enam kui 1000 meditsiiniasutust, mille aastane riigihangete maht on 1,7 miljardit eurot. Vähendamaks ebakindlust haiglates, apteekides ja vanadekodudes, viis ettevõte juba 2019. aastal läbi ulatusliku uuringu kõigi oma meditsiiniseadmete tarnijatega. Üheks järelduseks oli, et peaaegu kaks kolmandikku tootjatest töötab juba MDR-i akrediteeritud teavitatud asutusega. Katja Winkels zur Strassen, Prospitalia ärikonsultant räägib, kuidas sealset olukorda hinnata.
„26. mail 2020 ei saabu maailmalõpp. Euroopa Komisjon on selle taganud, pikendades enamike meditsiiniseadmete üleminekuperioode. Kuid isegi lisaks sellele oleme leidnud, et hirm ei ole põhjendatud. Vaid aasta tagasi ei olnud aga mitmed meie kontaktid haigla ja tarnijate poolel MDR-ist hästi informeeritud. Paljud neist ei teadnud näiteks, kas haiglates juba ladustatud tooteid on võimalik pärast CE-märgise aegumist kasutada. Kas on mõistlik varuda ühekordseid tooteid, näiteks kateetreid? Vastus: jah, sest kui toode jõuab haiglasse ning on seega kasutajale kättesaadav, loetakse see „kasutusele võetuks“. Kui aga tooteid, näiteks suuri seadmeid, pannakse kokku ainult kohapeal, on tegemist erijuhtumiga: kasutuselevõtt toimub alles pärast kokkupanemise lõpetamist. Ostuühinguna seisame tootjate ja tarbijate vahel, nii et meil on omamoodi pöördukse funktsioon. Selleks, et turule rohkem läbipaistvust tuua, korraldasime 2019. aasta suvel uuringu ja edastasime selle 180 tootjale, kas meid varustavad: 64% (mõõdetuna seotud asutuste hangete mahu põhjal) töötasid juba MDR-akrediteeritud teavitatud asutustega. Ja vähemalt kaheksa protsenti plaanivad seadmed turult kõrvaldada. Eeldame ka, et toimub turu konsolideerimine. See võib siiski olla loogiline. Mõned arstid töötavad näiteks harjumusest vananenud seadmetega, kuigi saadaval on uuemad alternatiivid, mis on patsientidele talutavamad: rasked ja väikesepoorilised songavõrgud vallandavad näiteks võõrkehareaktsioone sagedamini kui kaasaegsed seadmed. Täielike nišitoodete puhul (näiteks lasteravis kasutatavad seadmed) on seadusandjal võimalik tagada kättesaadavus riigisiseste erandiotsustega. Põnevaks küsimuseks saab see, kuidas hinnad arenevad. Meie uuringu kohaselt ei kavatse peaaegu ükski tootja hindu tõsta. Kuid sertifitseerimise kulud kahekordistatakse MDR-iga.“
6. jaam: keskmise suurusega
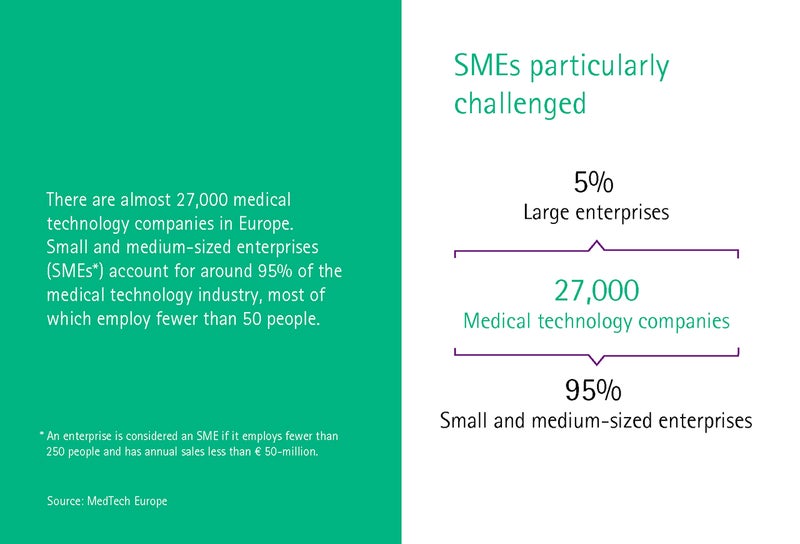
Saksamaa meditsiinitehnika tööstust iseloomustavad keskmise suurusega ettevõtted. 93% ettevõtetest on vähem kui 250 töötajat ning 30% vähem kui 10 töötajat. Tuttlingeni meditsiinitehnika klaster Medical Mountains töötab mitmete nende väikeste ettevõtete ja idufirmadega ning aitab neil MDR-iks valmistuda, nagu räägib tegevdirektor Yvonne Glienke.
„Kui praegu Tuttlingeni tänavatel regulatiivasjade eksperdina ringi käia, võib tööpakkumiste alla mattuda. Just väiketootjatel on probleeme vajalike oskustöötajate ligimeelitamisega. Korraldasime Medical Mountainsis 2019. aastal kokku 94 seminari enam kui 1000 osalejaga. Keskendusime sellistele teemadele nagu kvaliteedijuhtimine ja sertifitseerimine. MDR toob kaasa turu konsolideerimise. Just väikeettevõtete seisukoht selle kohta, kas pingutused on vaeva väärt, on aina enam eitav – nad ühendavad jõudusid, müüvad või muudavad oma ärimudeleid ja tegutsevad oma suurklientide pikendatud tööpingina. Oleme MDR-iga tegelenud juba üle kümne aasta, oleme rääkinud poliitikutega, kirjutanud seisukohti ning jätkame võitlust praktilisema rakenduse nimel. Näiteks, miks on vaja iga ühekordse skalpelli jaoks paberil kasutusjuhendit kõigis ELi keeltes? Kujutan ka ette, et mõned ettevõtted toovad oma uuenduslikud seadmed kõigepealt turule USA-s või Hiinas, et MDR-ist mööda minna. Kuid MDR-il on igal juhul üks eelis: piirkonna ettevõtetevaheline koostöö on oluliselt paranenud. Konkurentsi asemel on rohkem koostööd. See võib meid millegi uueni viia.“
7. jaam: inimfaktor
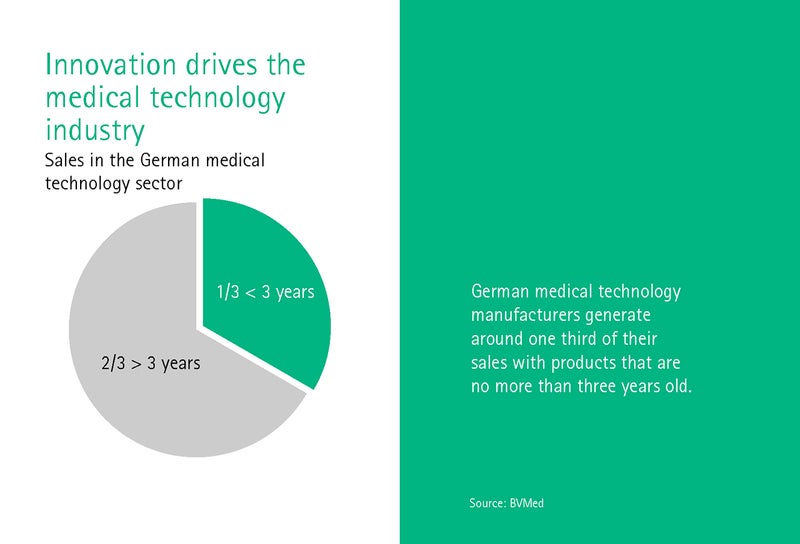
Dr Giovanni Rubeis töötab Heidelbergi ülikooli meditsiiniajaloo ja -eetika instituudis ning muretseb eelkõige digitaalse ülemineku eetiliste aspektide pärast. Rubeis küsib, milline peaks olema muutustega sammu pidav õiguslik raamistik? Meditsiinitehnika tööstus teenib ju kolmandiku käibest kuni kolme aasta vanustest seadmetest.
„Tervishoiusüsteem on kiiresti muutumas: praegu on näiteks allalaadimiseks saadaval 10 000 psühhoteraapia rakendust. Kuid kas need on meditsiiniseadmed? Ning kuidas liigitatakse ja reguleeritakse uusi tehisintellekti rakendusi, mis vaid mõned aastad tagasi tundusid meile mõeldamatud? Majandus muudab teadmised nii kiiresti seadmeteks, et seadusandlus suudab vaevu sammu pidada. See tehnoloogiline üleminek paneb ka MDR-i proovile. Patsiendi huvi on selge: seade peab mind aitama. Ja see peab olema ohutu. Eetilisest vaatepunktist peaksime seega rõõmustama, et reguleerivat raamistikku on karmistatud ja selgemaks tehtud. Mind paneb mõtlema aga see, et täiendavad kulutused tuleks katta sarnaste ressursside ja töötajate hulgaga. Seaduse vastuvõtmisest ei piisa. Tuleb tagada ka asjakohane infrastruktuur ja ressursid. MDR on väga keeruline asi. Ja see on ka eetiline probleem. Sest see on keeruline nii patsientidele kui ka meditsiinitöötajatele. On tõsi, et kogu teave peaks olema kättesaadav EUDAMED-i andmebaasis. Kuid see valmib alles 2024. aastaks ning on peamiselt suunatud spetsialistidele. Enamik inimesi muidugi usaldab oma arste, kuid määrusest üksi ei piisa meditsiiniseadmete sektorite vastu kaotatud usalduse taastamiseks. Poliitika ja äri peavad leidma viisi, kuidas patsientidega suhelda ning anda kogu vajalik teave, et patsiendid saaksid ise otsustada.“